秘鲁DIGEMID医疗器械注册返回 Back

秘鲁医疗器械注册

秘鲁医疗器械监管流程基于第29459号法律(药品、医疗器械和健康产品法)和第016-2013-SA号最高法令(药品、医疗器械和健康产品注册、控制和健康监督条例)及其修正案。秘鲁的医疗器械还适用其他一些法规。
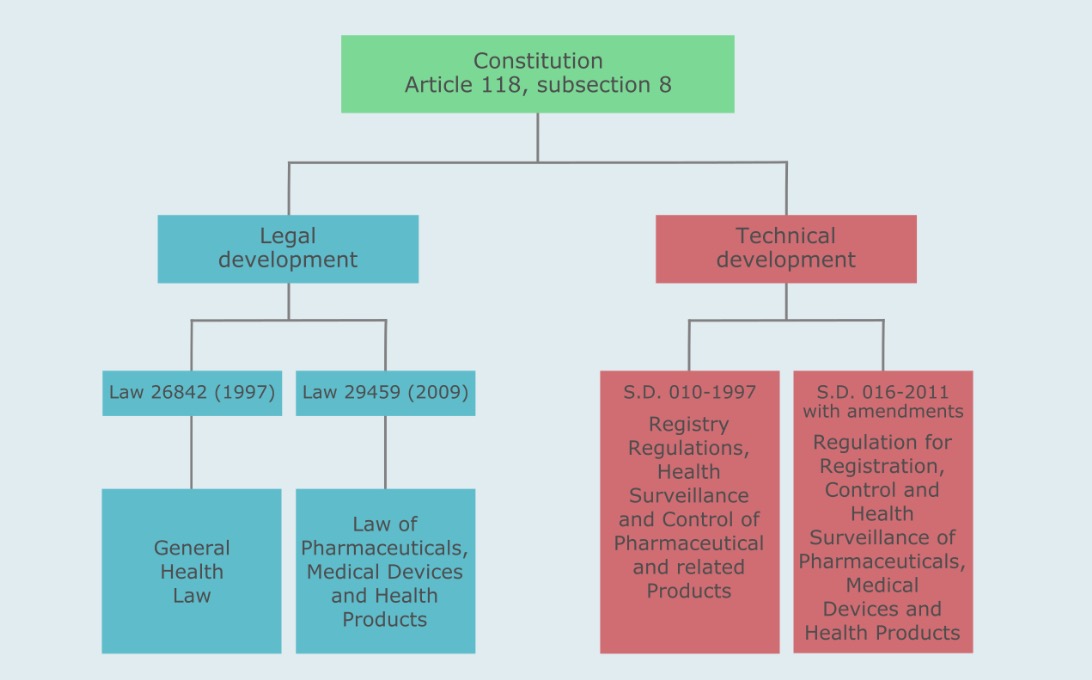
在秘鲁,负责医疗器械监管的机构是 Dirección General de Medicamentos,Insumos y Drogas(DIGEMID)。
该机构隶属于卫生部(Ministerio de Salud或MINSA)
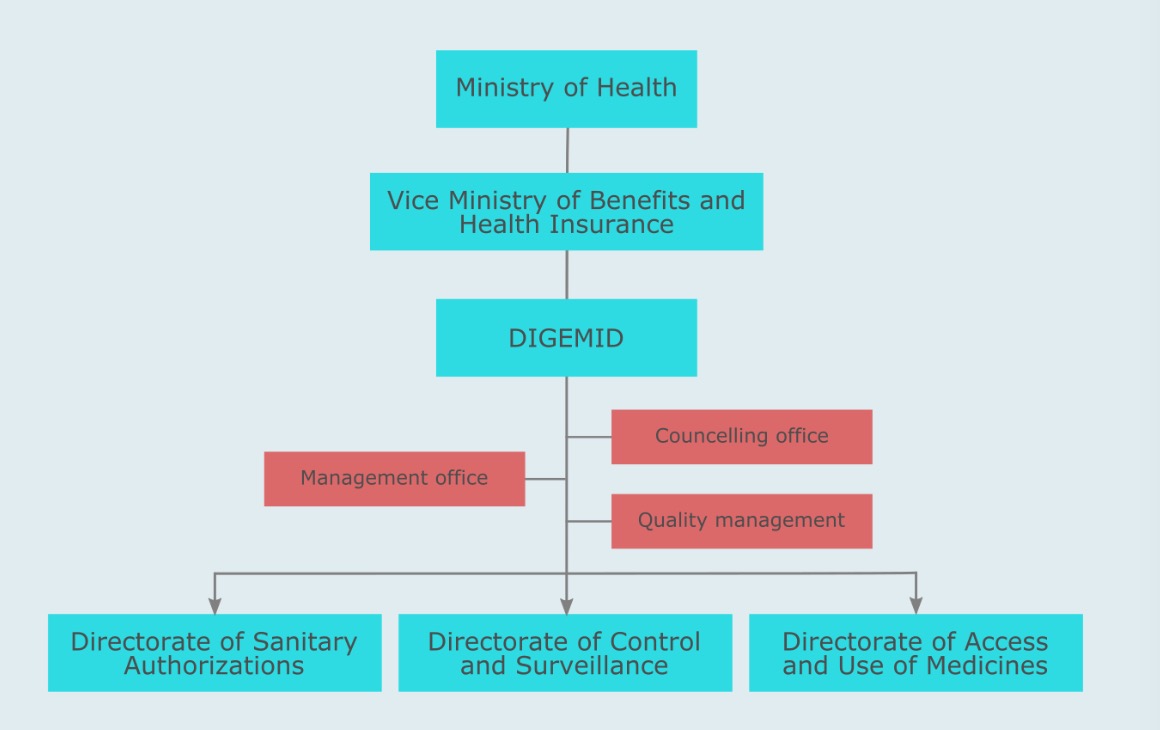
卫生授权局负责决定秘鲁医疗器械的注册和拒绝。一般而言,卫生授权局负责:
医疗器械注册
恢复
修改
拒绝
暂停
根据国家医疗器械法规,取消药品、医疗器械和卫生产品的卫生注册或卫生证书。

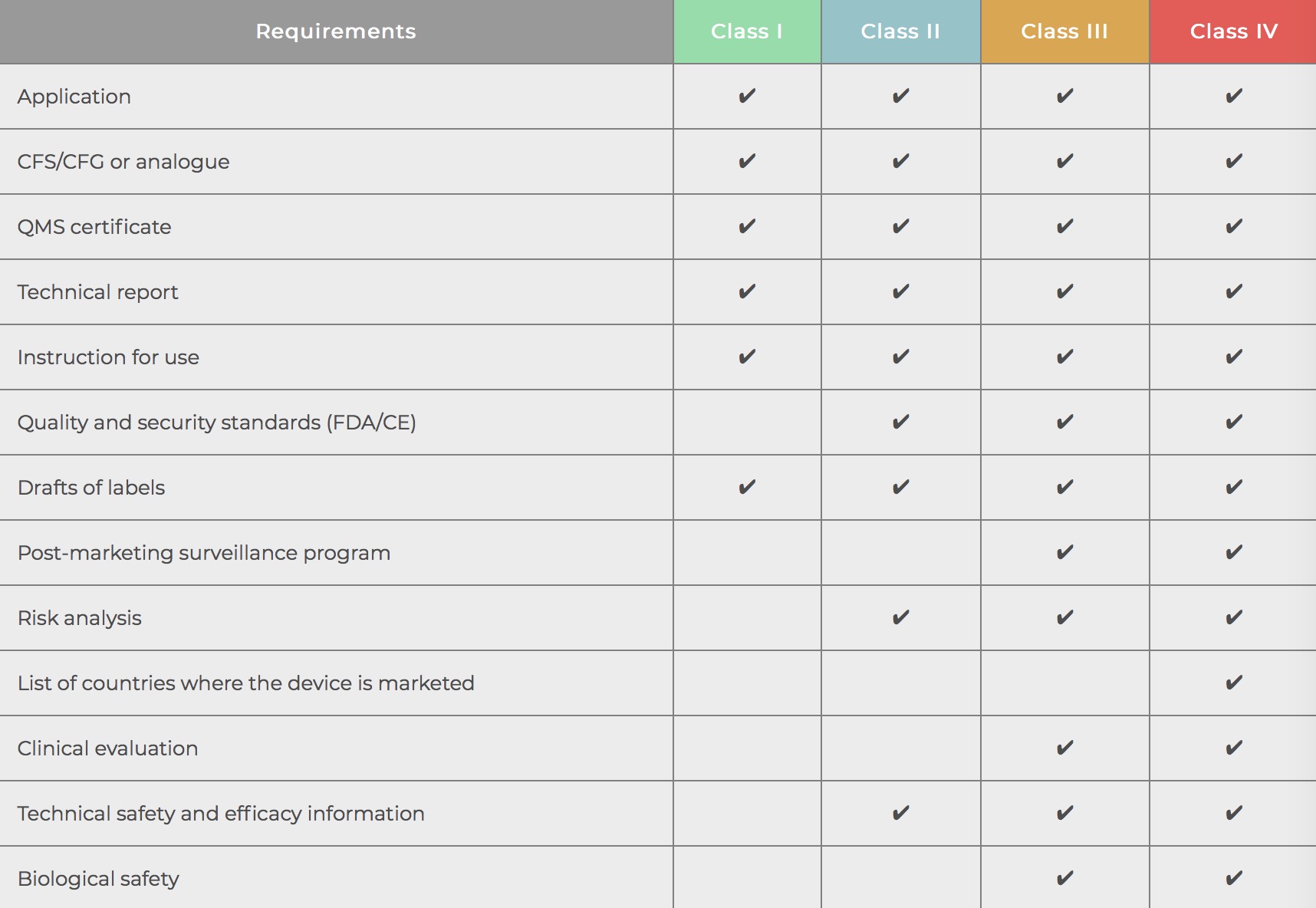
秘鲁的医疗器械根据其相关风险分为四类:
I类-低风险医疗器械
II类-中等风险医疗器械
第三类-高风险医疗器械
第四类-危险医疗器械
通过 RegDesk 警报,您可以随时跟踪变化,我们会在秘鲁监管部门发生变化时发出警告。
产品注册:
秘鲁所有医疗设备必须在DIGEMID注册,以便制造商能够在秘鲁销售。注册过程平均需要4到5个月,尽管准确的长度在很大程度上取决于设备的分类。风险较低的医疗器械通常审批速度较快,而风险较高的器械审批时间较长。
- Class I - 60 days
- Class II - 90 days
- Classes III, IV - 120 days

注册申请一经批准,注册证书有效期为5年。如果制造商打算在这段时间后继续在秘鲁销售他们的设备,他们必须提交续期申请。
对于总部位于秘鲁境外的制造商,还需要指定授权代表或秘鲁注册持有人(PRH),以便向DIGEMID成功注册设备。
PRH负责医疗器械注册,并且必须在其负责的器械标签上注明。

在秘鲁申请注册的设备制造商必须提供以下信息:
有关设备及其组件的详细信息
包装和标签信息
设备的所有测试结果
自由销售证书(CFS)或外国政府证书(CFG)(如适用)
在紧急情况下,可以在一种情况下使用、进口和/或制造未经官方营销授权的医疗器械。在这种情况下,DIGEMID必须给予制造商批准才能这样做。当迫切需要某一特定设备用于研究和培训目的或用于严重预防和个体治疗时,就会出现这种情况。
如下图所示:
秘鲁最新监管事务更新
2017年6月5日,DIGEMID发布了一项法令(文件以西班牙语书写),其中包括以下变更:
简化了制造商获取进口证书的要求。
现在需要中高风险医疗器械的风险管理报告。
所有医疗器械类别的官方审查时间已缩短30天。

