ISO 10993-1返回 Back
Test item 测试名称: Evaluation and testing within a risk management 生物兼容性评估说明
Test info 测试内容:
1. 标准范围
a) 指导医疗器械生物学评价的基本原则
b) 按器械与人体接触的性质和时间分类
c) 有关试验的选择
2. 医疗器械
医疗器械(medical device)
由制造者专门或主要设计成为下列目的应用于人体的,不论是单独使用还是组合使用的,包括使用所需软件在内的任何仪器、设备、器具、材料或者其他物品,这些目的是:
——疾病的诊断、预防、监护、治疗或缓解;
——伤残的诊断、监护、治疗、缓解或代偿;
——人体结构或生理过程的研究、替代或修复:
——妊娠的控制。
其对于人体内或人体上的主要预期作用不是用药理学、免疫学或代谢的手段获得,但可能有这些手段参与并起一定辅助作用。
注:医疗器械不同于药品,其生物学评价也与药品不同;“医疗器械”包括牙科器械。
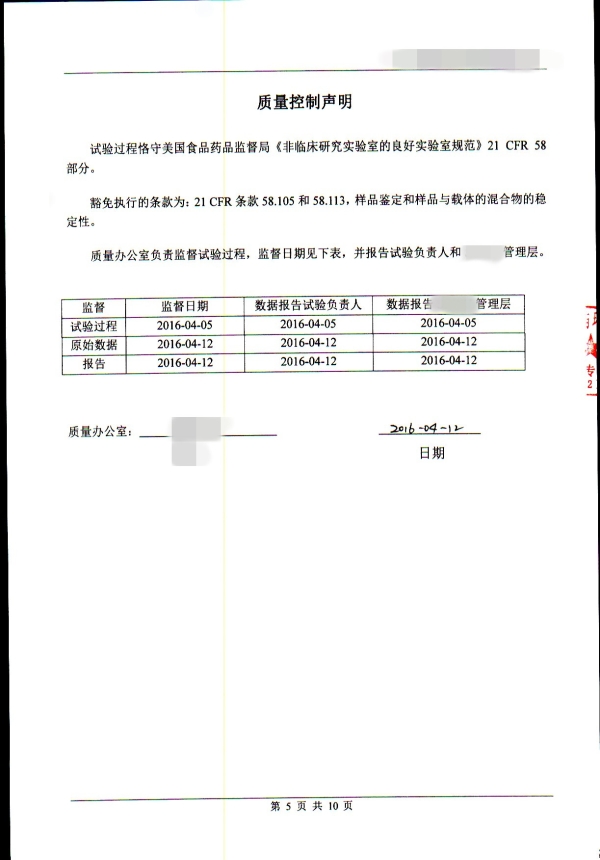
3. 试验报告
器械总体生物学评价建议考虑以下方面:
a)生产所用材料;
b)添加剂、加工过程污染物和残留物;
c)可沥滤物质;
d)降解产物;
e)其他成分以及它们在最终产品上的相互作用;
f)最终产品的性能与特点。
4. 医疗器械分类
(1) 按人体接触性质分类:
非接触器械
表面接触器械
外部接入器械
植入器械
(2) 按接触时间分类:
短期接触:一次或多次使用接触时间在24小时以内的器械
长期接触:一次、多次、或长期使用接触在24小时以上30天以内的器械
持久接触:一次、多次、或长期使用接触超过30日的器械
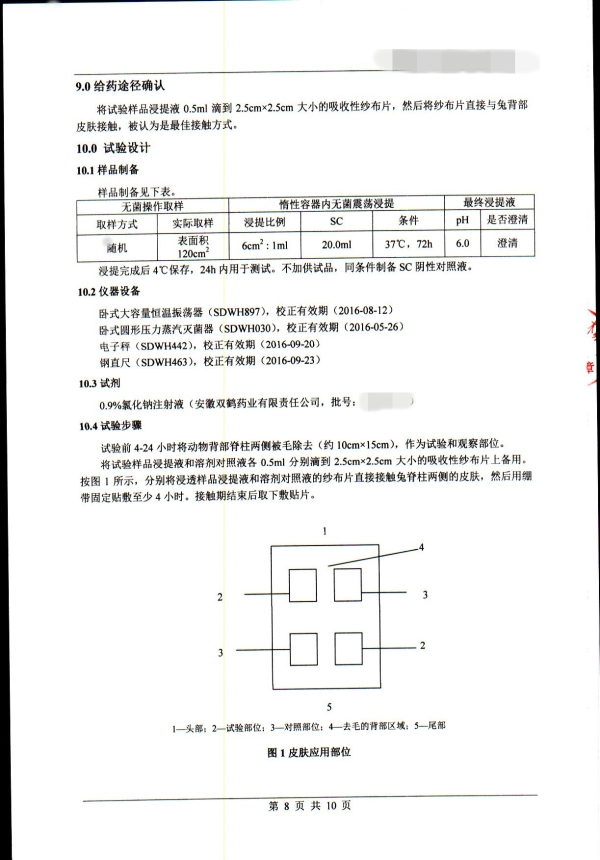
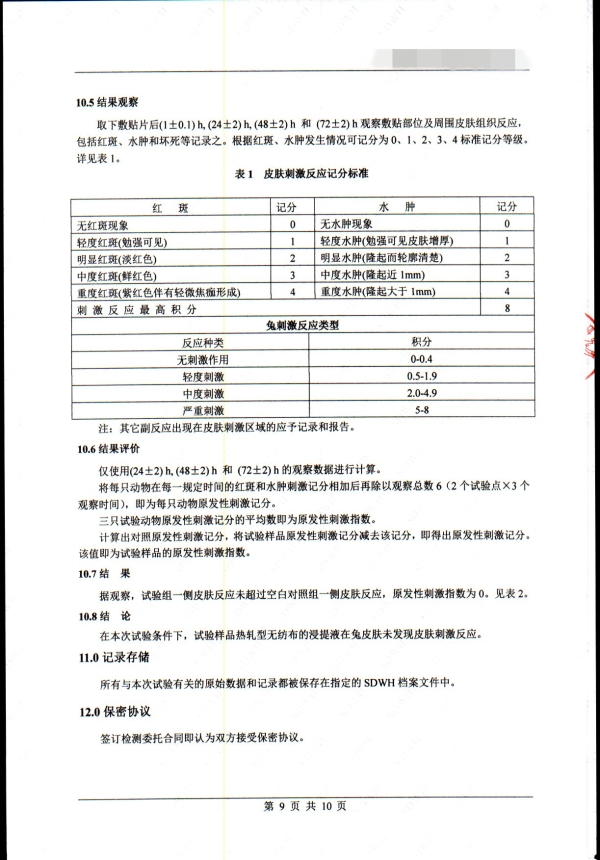
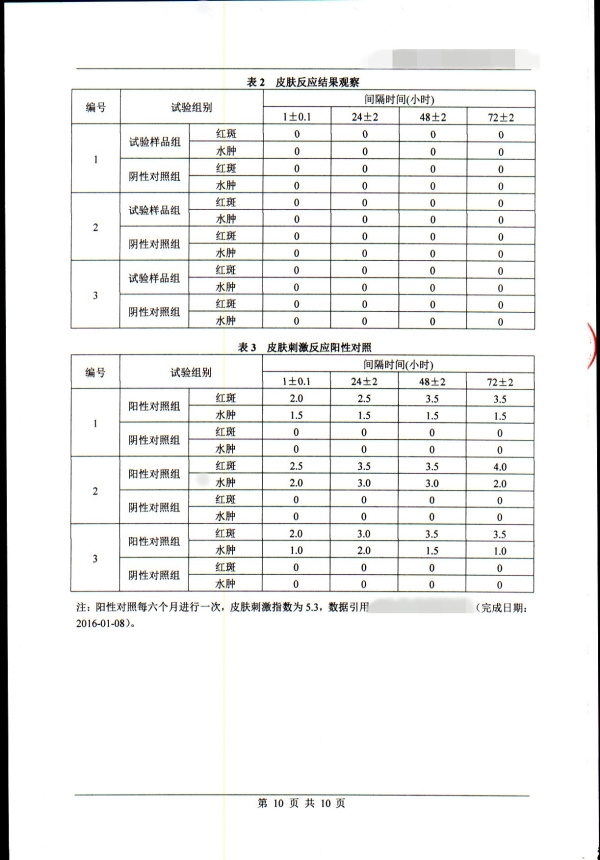
5. 基本评价试验涉及内容
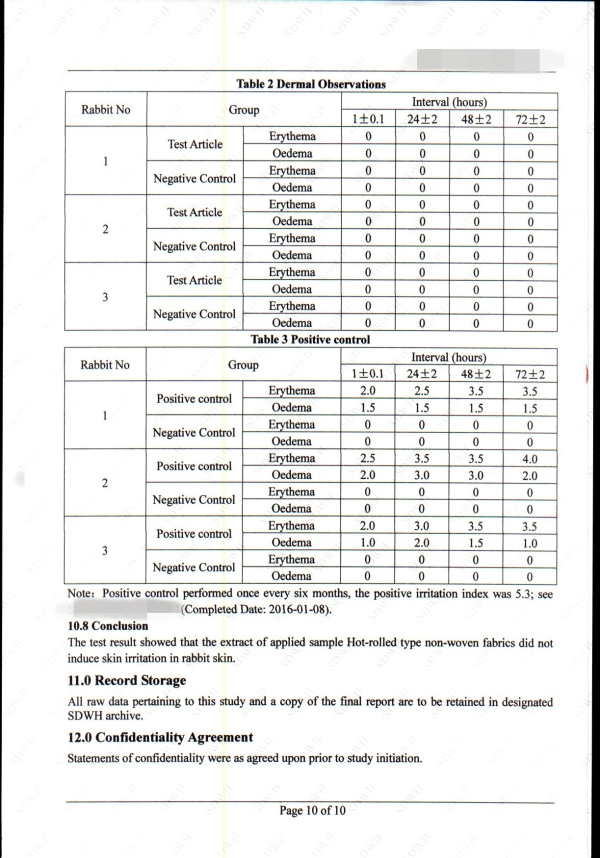
细胞毒性
致敏
刺激
皮内反应
全身毒性(急性毒性)
亚慢性毒性(亚急性毒性)
遗传毒性
植入
血液相容性
补充评价试验:
慢性毒性
致癌性
生殖与发育毒性
生物降解
Sample size 送样规格:4pcs
Lead time 测试周期: 常规 Regular 60 working days
Others 其他信息:


Sample report: