Chemical characterization of medical device materials within a risk management process
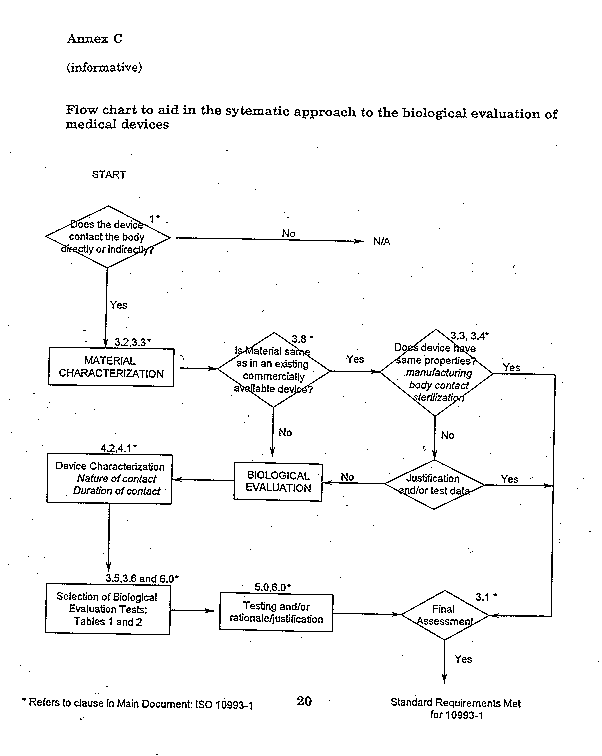
FDA評估醫療器材安全性,是基於患者接觸醫療器材使用的部位及時間長短,可能有暴露於化學毒性的風險,所以溶出與萃出的化學風險評估是必須被考慮進去的。

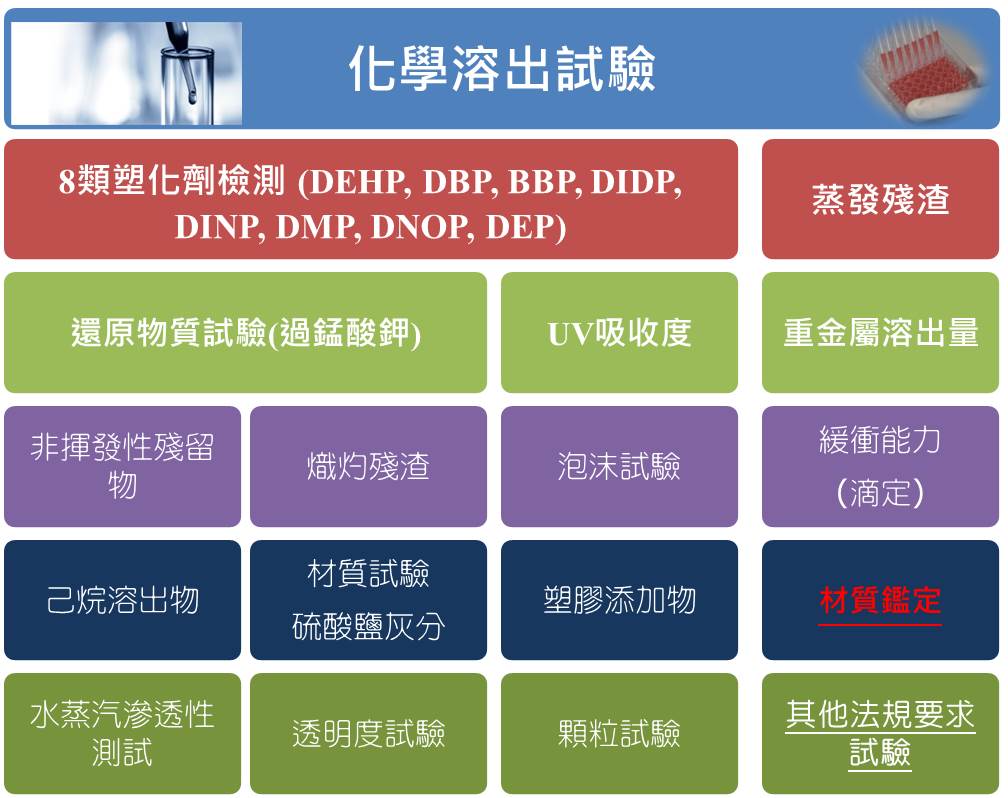
ISO 10993-18 醫療器材溶出試驗
在ISO 10993中 醫療器材萃取物/溶出物評估與研究 在產品開發中占有重要的步驟。
醫療器材材料的組成需藉由一步步的化學試驗步驟來分析出裡面成分中可能的生物有害物質,ISO 10993-18既是針對對醫療器材材料組成分析的方法學也是醫材風險分析的一環,可以對分析出來的物質進行鑑定和含量分析,作為醫療器材供應商評估生物學相容性的依據。
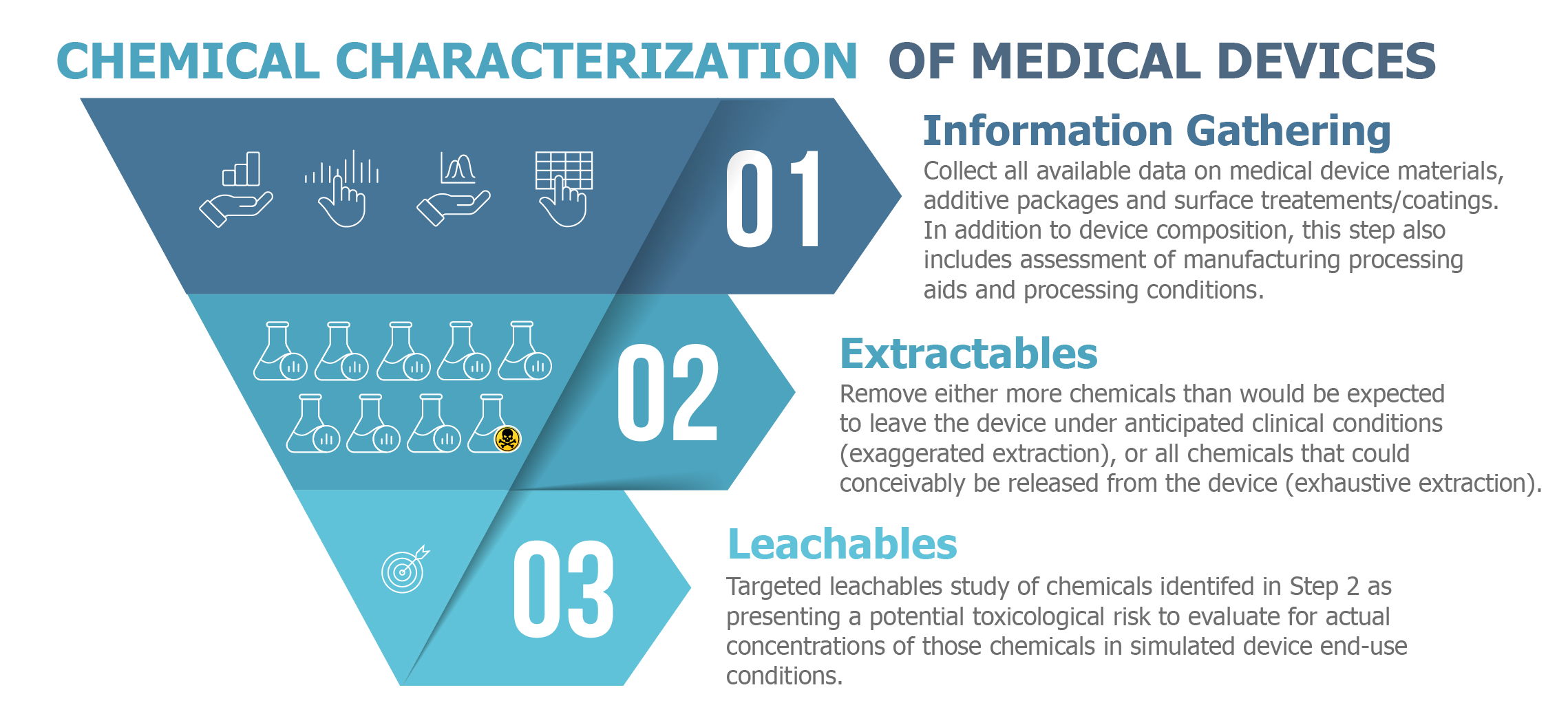
ISO 10993-18之測試目的:
鑑定出醫療裝置材料的結構組成。
經由材料中化學成分的鑑別及定量材料的特性。
在經由製造過程中是否有化學物質遷入進醫療器材之中(脫模劑、滅菌殘留、製程汙染物)。
模擬臨床使用下在實驗室萃取條件對萃出物的化學物質進行研究。
模擬臨床使用下對溶出物的化學物質進行研究。

哪種醫療器材產品需要做溶出萃出試驗?
依據美國FDA於2020年公開建議針對ISO 10993-01的醫療器材化學評估,有以下幾個條件需要做醫材材料化學測試:
新穎的材料,從未在美國上市過的醫療器材材料。
藉由一些界面活性劑、增塑劑、抗氧化劑來改善材質特性和製程之醫材。
已知使用具有一定毒性的化學物質組合藥物或是生物製劑醫材組合產品,需要做材料的化學評估並且需和基因毒及腫瘤毒性一起評估佐證。
一些醫材材料可預期會隨時間而材質有所改變特性,如組合性材料或降解性材料。
在生物相容性測試中有一些未預期的結果,可能需要多做材料的化學性試驗一起評估。
一些醫療器材材料雖然已長久被使用(如:輸液套管),但沒有足夠資訊了解在製程方法中及添加於醫材的添加劑的毒性,需要做醫療器材化學評估。