日本PMDA医疗器械注册
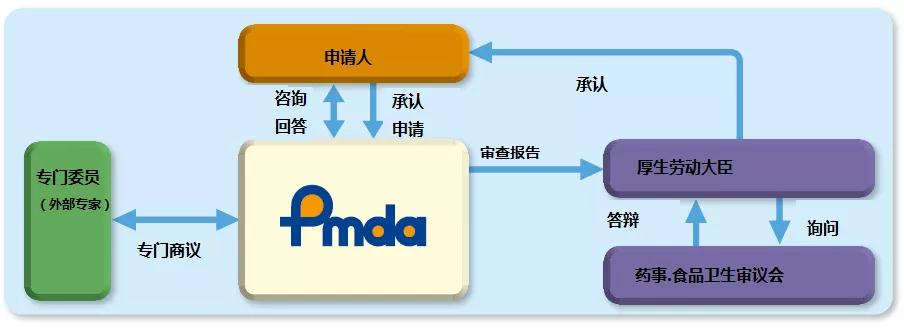
所有medical产品进入日本都要注册日本PMDA
医疗器械公司把产品投放到日本市场必须要满足日本的 Pharmaceutical and Medical Device Act (PMD Act), Ministry of Health, Labour and Welfare (MHLW)下属部门Pharmaceuticals and Medical Devices Agency (PMDA)目前也出版了一小部分英文的法规。
MAH和DMAH。两个都可以作为日本代理人,很多 日本药妆店也持有MAH,可以让客户去找日本药妆店
拥有在日本的销售授权许可证(MAH)。
MAH在日本设有办事处,并且:
控制产品的注册,并作为申请人成为认证的所有者,当它被授予。
由于上述批文的所有者是MAH,独立提交补充申请或不需要外国制造商签字的认证申请。
指定营销授权持有人(DMAH)为没有在日本设立办事处的公司充当MAH。
外国公司可以指派DMAH在日本处理所有与质量有关的责任,并且:
代表外国公司办理产品注册事宜。
但是,DMAHs不是认证的所有者,因为申请是由外国公司做的,他们是认证的所有者。
协助提交需要外国公司签字的申请、补充或转让申请

抗原类产品证书样本

“Toroku”注册
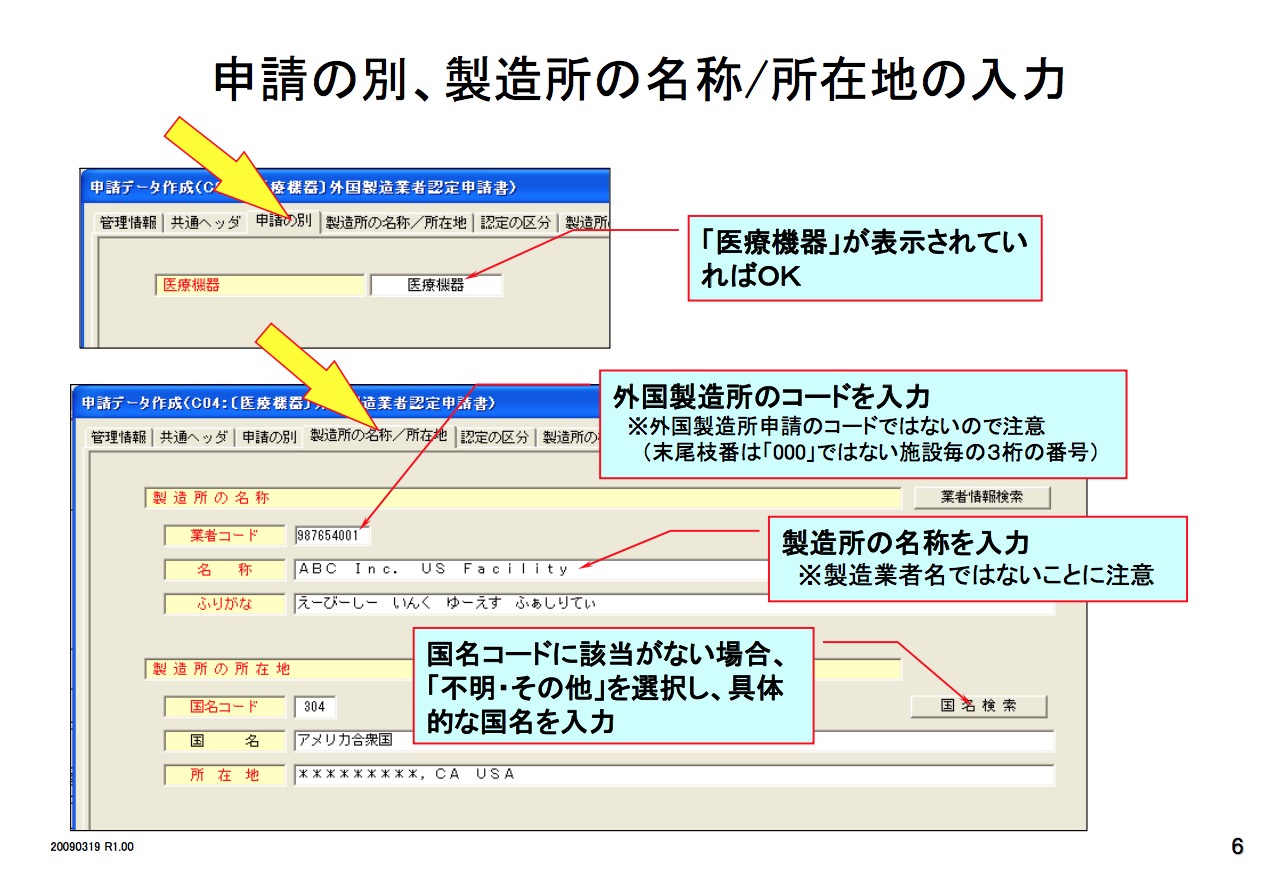
在PMD Act的要求下,TOROKU注册系统要求国内的制造商必须向政府授权的当地的主管机关注册工厂信息,包括产品设计,生产,关键工序的信息;国外的制造商必须向PMDA注册制造商信息。
“Todokede, Ninsho and Shonin”程序
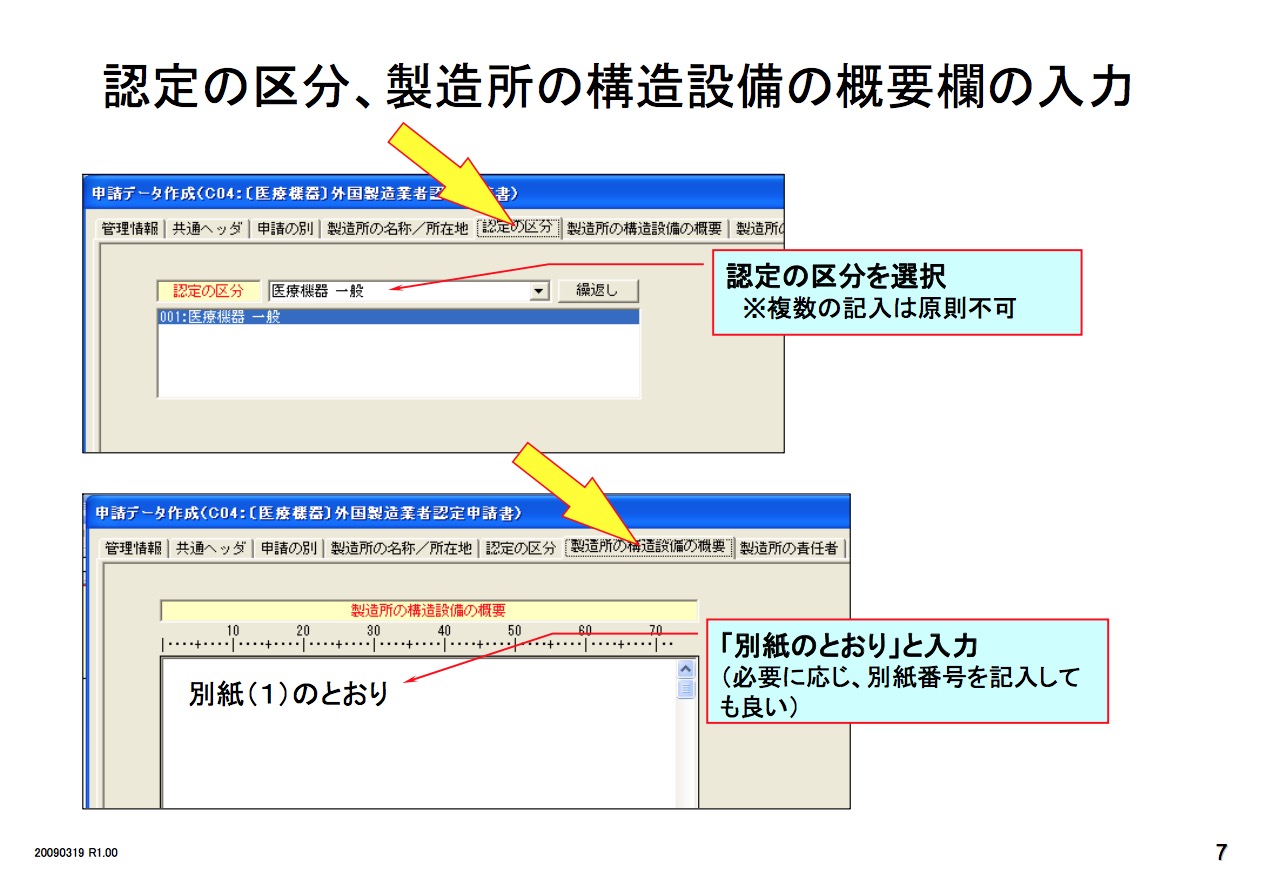
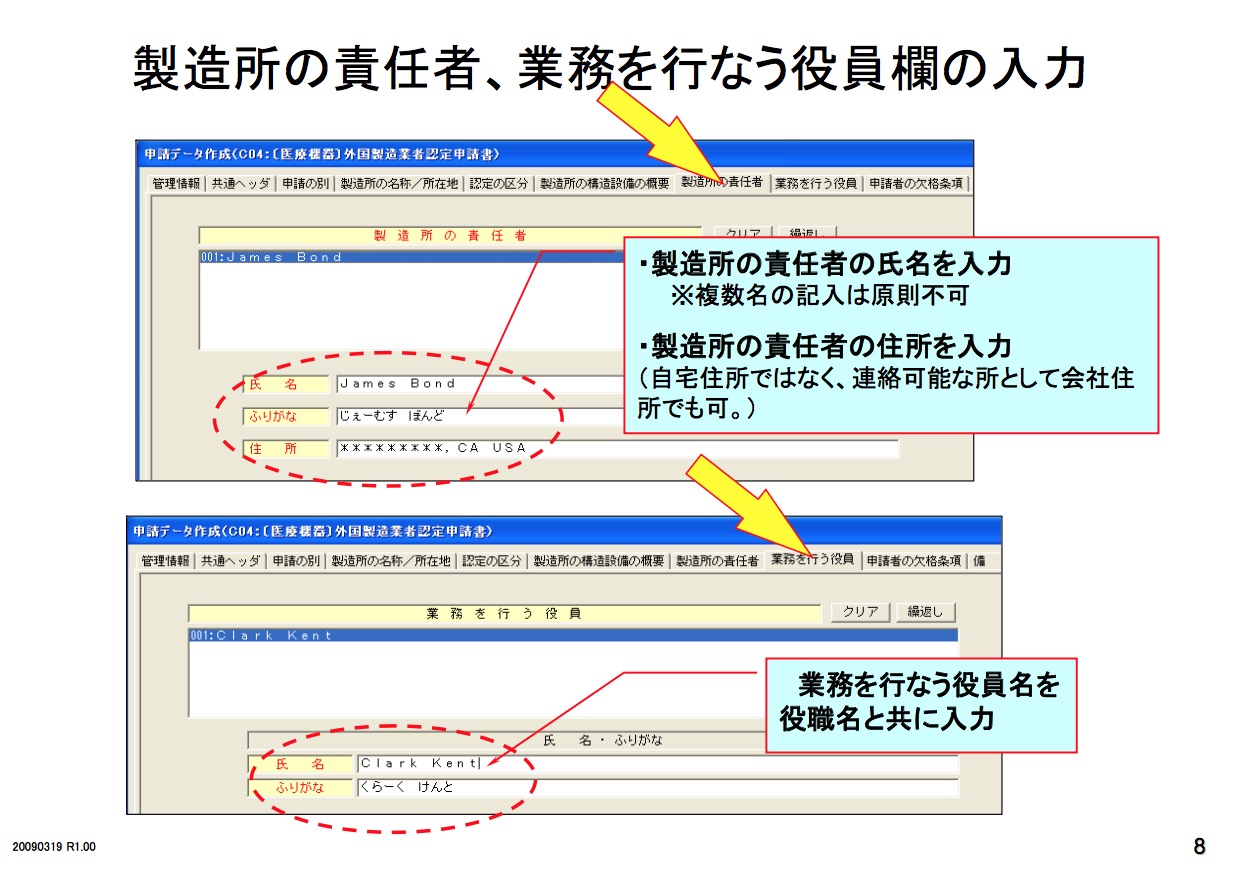
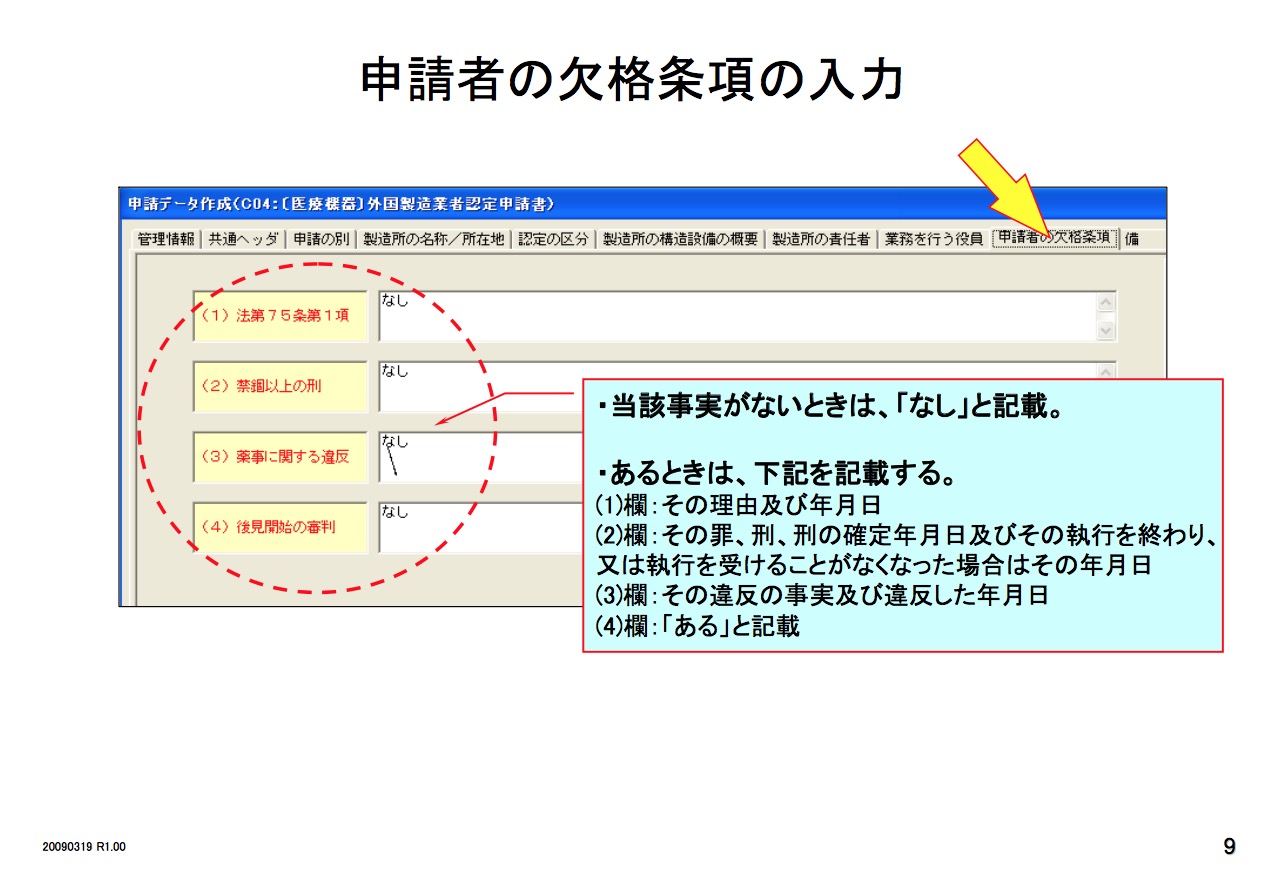
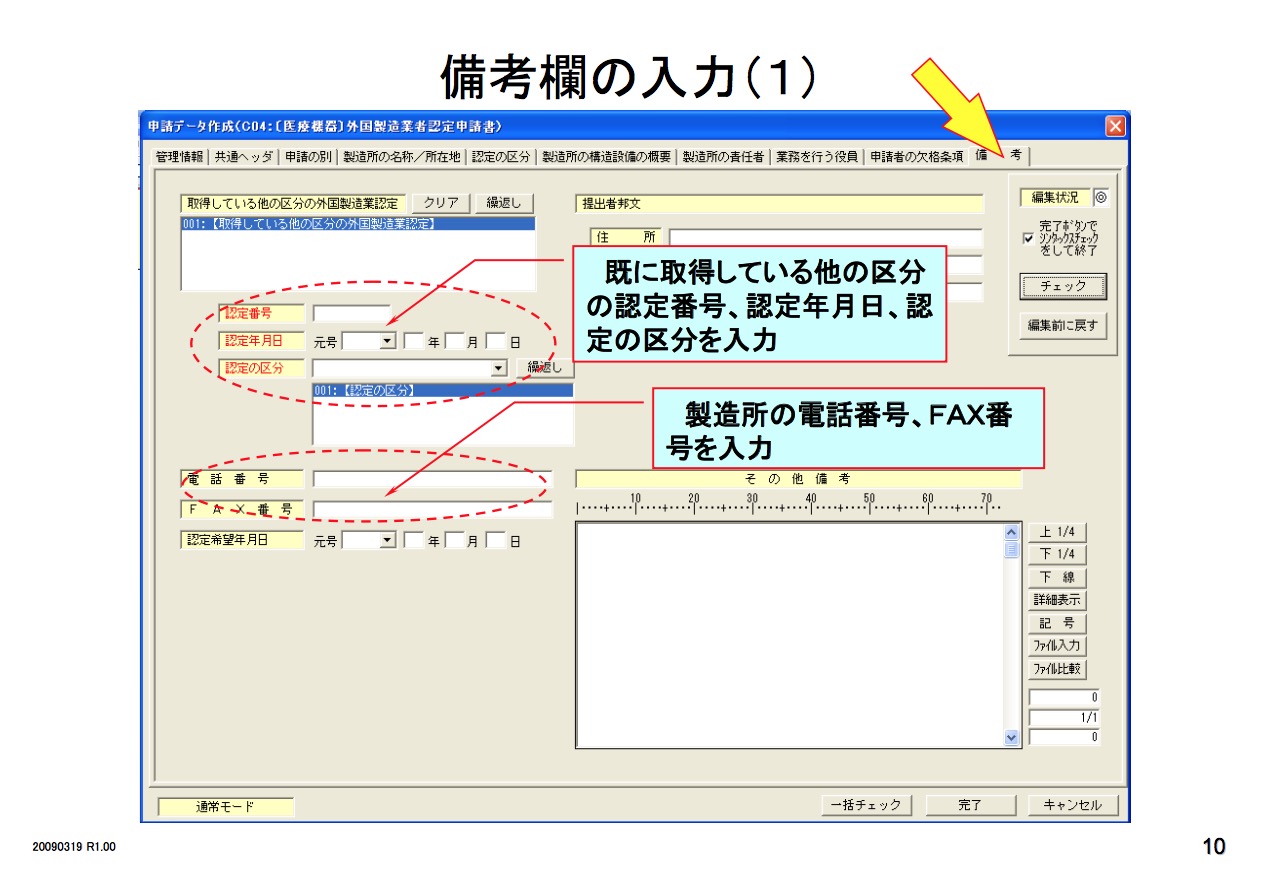
医疗器械必须要由其市场授权人MAH 或DMAH (Marketing Authorization Holder or Designated Marketing Authorization Holder)通过以下程序去注册其产品。
Class I 器械 - 上市前提交Todokede
I类器械上市前必须由其MAH或DMAH像PMDA提交一份上市前提交文件,这份文件不需要经过PMDA的审核和批准。
Class II 器械 - 上市前认证Ninsho
作为特殊控制的II类器械上市前必须要经过上市前认证。认证机构(PCB)为PMDA授权可以进行PMDA认证的机构。
lass II,III,IV 器械 - 上市前批准Shonin
除了特殊控制的II类器械外的其他II类器械和III,IV类器械必须要由其MAH或DMAH像PMDA提交上市前批准的申请,并经过日本PMDA批准后才能注册他们的产品,并投放市场。
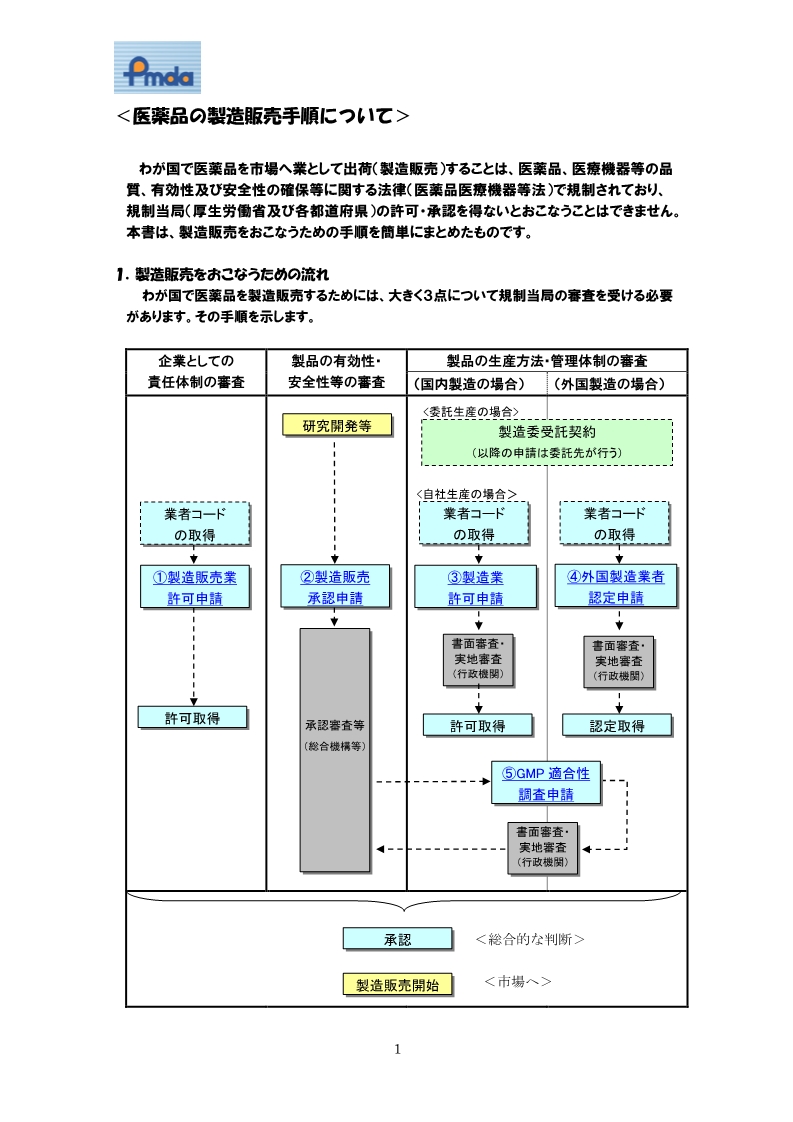
日本PMDA注册步骤:周期8个月
第一步:准备阶段。确定产品分类(I,II特殊控制,II类控制,III,IV)和产品JMDN编码,选择日代MAH
1个月
第二步:制造商向PMDA注册工厂
1个月
第三步:II类特殊控制产品向授权认证机构PCB申请QMS工厂审核,其他II类产品和III类IV类产品向PMDA申请QMS工厂审核,并获得QMS证书
3个月
第四步:申请Pre-Market Apporval证书,II类特殊控制由PCB发证,其他II类产品和III类IV类产品控制由MHLW发证。
3个月
第五步:支付申请费用
第六步:注册文件整改,注册批准
第七步:所有类别产品均需要MAH向RBHW进行进口通报注册后才能进口销售
日本口罩分成三个类别:1)防尘标准口罩;2)医用口罩;3)家用口罩。
1)产业用防尘标准口罩(呼吸防护设备)
我们来具体看一下,产业用的防尘标准口罩的具体分类,分别可以通过产品用途和检测种类进行划分:
a)按照用途区分
|
用途描述 |
具体类别 |
|
・在放射性物质溢出造成污染的地区进行工作或紧急工作 ・可能会暴露二恶英的工作 ・与上述工作相似的其他工作 |
RS3 RL3 *如果存在油雾等,则选择L |
|
・在散发金属烟雾(包括焊接烟雾)的地方工作 ・在浓度为0.1 mg / m3(* 1)以下的尘埃和其他物质排放的地方工作 ・与上述工作相似的其他工作 * 1:镉,铬酸,重铬酸,铍,铅及其化合物 |
DS2 DL2 RS2 RL2 更高的颗粒收集效率 DS3 DL3 RS3 RL3 *如果存在油雾等,则选择L |
|
上述以外的粉尘工作环境 |
DS1 DL1 RS1 RL1 更高的颗粒收集效率 DS2 DL2 RS2 RL2 DL3 DS3 RS3 RL3 *如果存在油雾等,则选择L |
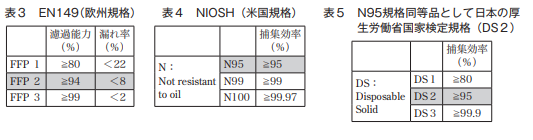
b)按检测种类进行划分为12种(DS1至RL3):
|
一次性/可更换\测试颗粒和收集效率 |
S 使用固态氯化钠(NaCl)作为测试颗粒进行测量 |
L使用邻苯二甲酸二辛酯(DOP)作为测试颗粒进行测量 |
1/2/3类 |
|
D |
DS3 |
DL3 |
3类:99.9%以上 |
|
DS2 |
DL2 |
2类:95%以上 |
|
|
DS1 |
DL1 |
1类:80%以上 |
|
|
R |
RS3 |
RL3 |
3类:99.9%以上 |
|
RS2 |
RL2 |
2类:95%以上 |
|
|
RS1 |
RL1 |
1类:80%以上 |
翻译:职业健康和安全法要求企业在要求工人进行某些危险工作时,必须佩戴防毒面具等呼吸保护设备。在这些防毒口罩中,防毒面具要求制造商和进口商在销售之前都要经过型号认证,以确保它们符合要求的国家标准。
2)家庭用口罩
a)不能过分强调家庭用口罩的防病毒的效果。
下面就是一个比较通用的标识方式。
家庭用マスクは、外からの微粒子の侵入を完全に防止することには限界があることから、「マスクは感染(侵入)を完全に防ぐものではありません」。
翻译:家用口罩在完全防止外来颗粒侵入方面有局限性。家用口罩不能完全防止感染(侵入)。
b)用数字表示过滤器单元的质量性能时,请指明测试方法或测试机构。
c)显示的项目与测试方法要相互对应。
3)医用口罩
小结:如果短时间内,希望进入日本市场,按家庭用口罩申报相对快些。医用口罩可以走一类,但是需要有相关技术文档和体系支持,且在MHLW做制造商登入。